
Ягодинский
7 год назад
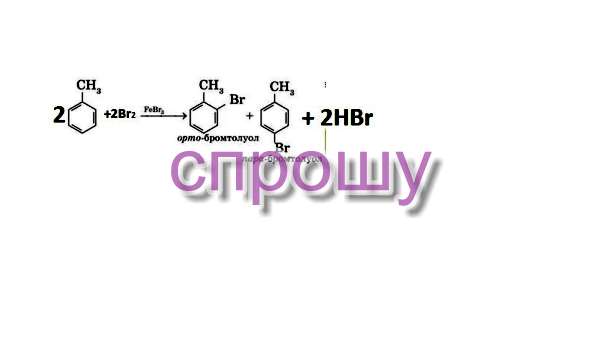
Написать механизм реакции бромирования толуола (условия: FeBr3).
ОТВЕТЫ

Bronislav
Jun 30, 2019
При обычной температуре в присутствии катализатора (FeCl3) бром замещает водород в ядре в орто- или пара-положении к боковой цепи (так как радикалы - заместители I рода); при отсутствии катализатора, при нагревании и под действием яркого света атомы брома становятся в боковую цепь (образуется бензилбромид)
Я попробую в краце.
Как известно это реакция электрофильного замещения. Бром, как нейтральная молекула (Br₂), слабый электрофил для реакции с бензолом без катализатора. Надо "активировать" бром, чтоб он захотел "присоединиться" к бензолу. "Активация" брома идет по кислотно-основной реакции с кислотой Льюиса (FeBr₃). Кислота Льюиса это кислота, способная принять электронную пару на свободную орбиталь. Основание Льюиса (Br₂) это основание, отдающее эту пару. И вот свободный ион брома (Br⁺) стал сильным электрофилом, так же образованный комплекс с электронной парой (FeBr₄⁻) является сильным электрофилом (в конце он соединит бром с водородом). В бензольном кольце все атомы водорода равноценны, но как только появляется заместитель (CH₃), эта равноценность теряется.CH₃ это орто- и пара- ориентант, т.е. он направит электрофил в орто- и(или) пара- положение бензольного кольца. Попробую изобразить вышеизложенное:
1) "активация" брома для реакции кислотой Льюиса;
2) бром-ион присоединяется к кольцу, разрывая ароматичность;
3) отделяется водород, образуется ароматичность (реароматизация);
4) конечные продукты реакции (образуется смесь орто- и пара-бромтолуола)
Что-то вроде того
Как известно это реакция электрофильного замещения. Бром, как нейтральная молекула (Br₂), слабый электрофил для реакции с бензолом без катализатора. Надо "активировать" бром, чтоб он захотел "присоединиться" к бензолу. "Активация" брома идет по кислотно-основной реакции с кислотой Льюиса (FeBr₃). Кислота Льюиса это кислота, способная принять электронную пару на свободную орбиталь. Основание Льюиса (Br₂) это основание, отдающее эту пару. И вот свободный ион брома (Br⁺) стал сильным электрофилом, так же образованный комплекс с электронной парой (FeBr₄⁻) является сильным электрофилом (в конце он соединит бром с водородом). В бензольном кольце все атомы водорода равноценны, но как только появляется заместитель (CH₃), эта равноценность теряется.CH₃ это орто- и пара- ориентант, т.е. он направит электрофил в орто- и(или) пара- положение бензольного кольца. Попробую изобразить вышеизложенное:
1) "активация" брома для реакции кислотой Льюиса;
2) бром-ион присоединяется к кольцу, разрывая ароматичность;
3) отделяется водород, образуется ароматичность (реароматизация);
4) конечные продукты реакции (образуется смесь орто- и пара-бромтолуола)
Что-то вроде того
16
